| 我校博士研究生在Science Advances发表重要研究成果 |
| 发布时间:2022-09-11 | 浏览次数: 1344 |
我校生命科学学院生物化学与分子生物学专业2021级、2018级博士研究生赵燕波、刘梦茜等为共同第一作者在国际学术期刊Science Advances在线发表了题为“Pathogen effector AvrSr35 triggers Sr35 resistosome assembly via a direct recognition mechanism”的研究论文。我校为该研究工作的第一完成单位,二位博士研究生的指导老师欧阳松应教授和南方科技大学电镜中心王培毅教授为本文的共同通讯作者。该研究工作得到国家重点研发计划项目、国家自然科学基金项目、中国科学院项目和中国博士后科学基金项目等资助。

该研究证实单粒小麦(Triticum monococcum)的CNL蛋白Sr35可直接识别来自秆锈真菌(Puccinia graminis f. sp. tritici)Ug99的效应蛋白AvrSr35,并分别通过冷冻电镜技术和X-射线衍射晶体学技术解析了Sr35抗病小体结构和AvrSr35的晶体结构。结构分析和生化实验结果表明,AvrSr35通过与Sr35的LRR结构域直接相互作用,在ATP的辅助下形成由Sr35-AvrSr35异源二聚体复合物组装而成的环状五聚体蛋白,即Sr35抗病小体(图1)。ATP分子结合在NOD结构域中部,位于基序P-loop的K206和TT/SR的R311为NLR蛋白结合ATP γ磷酸基团的保守氨基酸位点。晶体结构显示AvrSr35在溶液中为同源二聚体构象,其二聚界面与结合Sr35的相互作用界面完全重合,结合体外生化实验和植物生理学实验结果,该研究发现Sr35对AvrSr35的直接识别会引起AvrSr35二聚构象的解离。
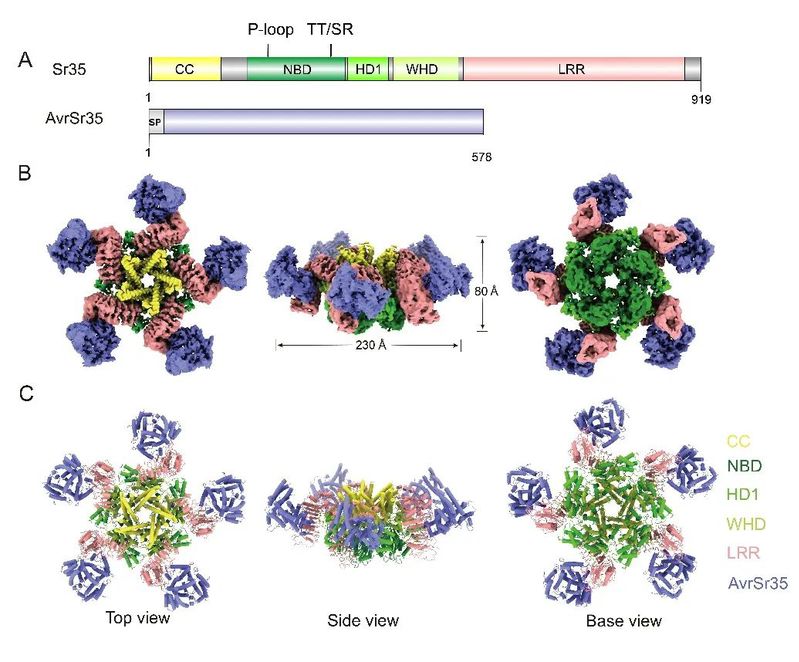
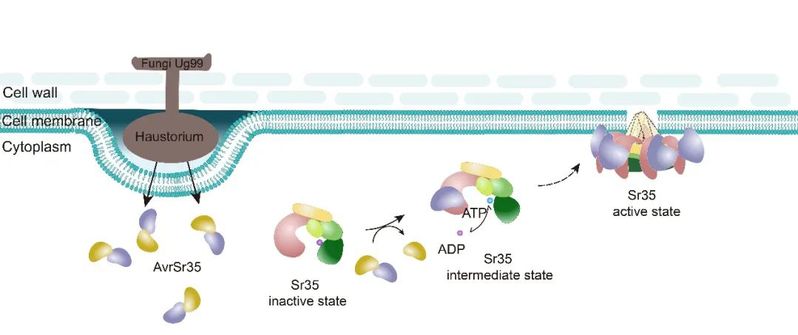
在Sr35抗病小体中,CC结构域的三螺旋束相互堆积形成“漏斗”状构象扣在圆环结构上方。“漏斗”底部关键疏水氨基酸Y141A的突变体抑制了五聚构象的组装,也消除了其在叶肉细胞中的死亡诱导活性,故CC结构域的寡聚对Sr35介导的抗病功能具有关键作用。另外,该研究发现Sr35的1-20位氨基酸的截短突变体Sr3520并不抑制抗病小体的组装但阻隔了免疫信号的传导。烟草叶肉细胞的亚细胞定位结合质壁分离实验以及拟南芥原生质体定位分析显示,Sr35激活各阶段均与细胞膜相关联,包括突变体Sr3520,说明Sr35免疫活性的发挥或与细胞质膜有紧密联系,也说明了Sr35的1至20位氨基酸是Sr35介导的免疫所必需的,但与质膜无关。该研究结果揭示了植物CNL的直接识别和激活机制(图2),暗示了环状五聚或许是激活态CNLs的普遍现象,并为Sr35抗病小体的生化功能提供了见解。
论文链接:https://www.science.org/doi/10.1126/sciadv.abq5108

